सभी जैविक कार्य इस बात पर निर्भर करते हैं कि विभिन्न प्रोटीन एक दूसरे के साथ कैसे बातचीत करते हैं। प्रोटीन-प्रोटीन इंटरैक्शन डीएनए को स्थानांतरित करने और कोशिका विभाजन को नियंत्रित करने से लेकर जटिल जीवों में उच्च-स्तरीय कार्यों तक सब कुछ सुविधाजनक बनाते हैं।
बहुत कुछ स्पष्ट नहीं है, हालांकि, इन कार्यों को आणविक स्तर पर कैसे ऑर्केस्ट्रेट किया जाता है, और कैसे प्रोटीन एक दूसरे के साथ बातचीत करते हैं – या तो अन्य प्रोटीन के साथ या खुद की प्रतियों के साथ।
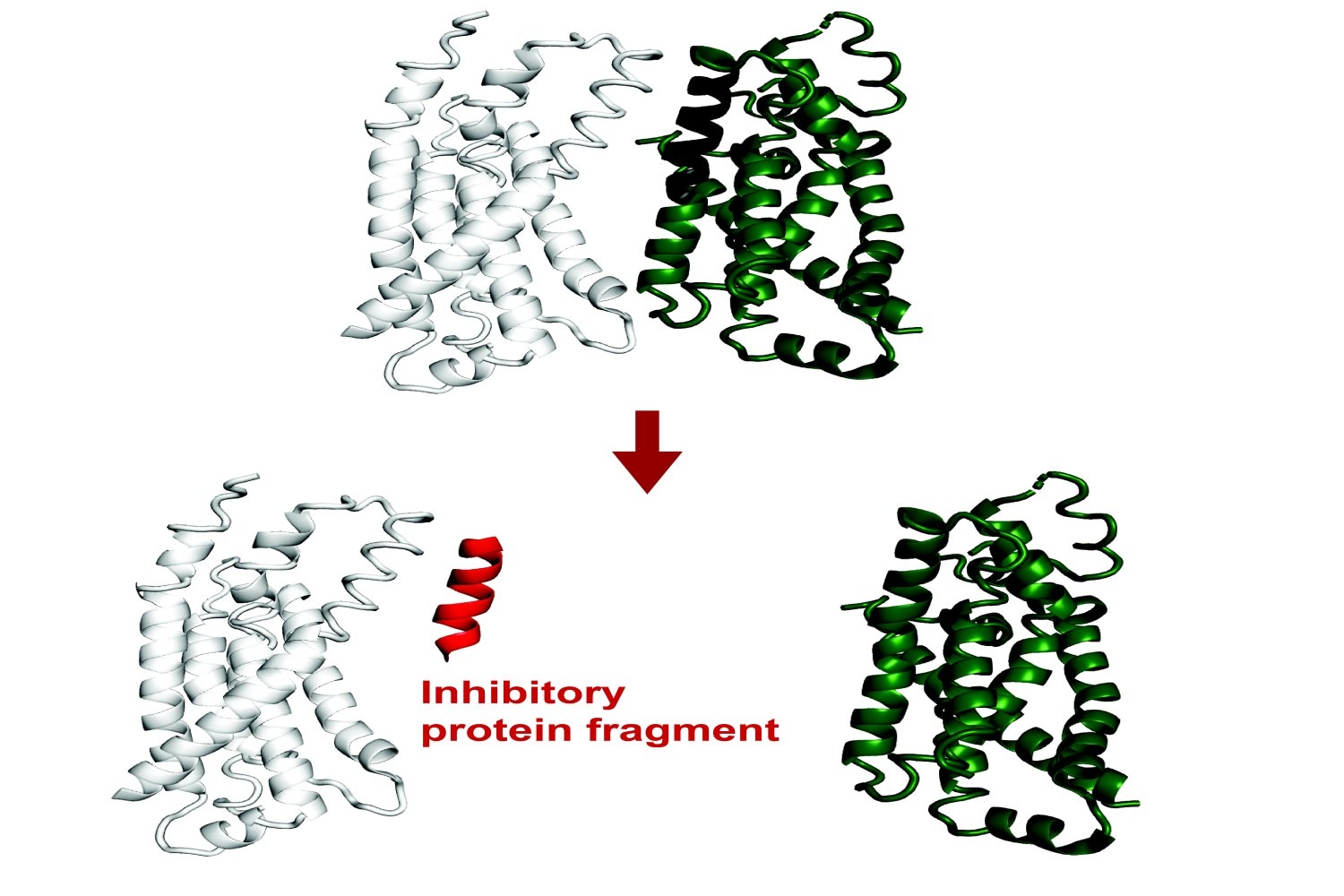
हाल के निष्कर्षों से पता चला है कि छोटे प्रोटीन टुकड़ों में बहुत अधिक कार्यात्मक क्षमता होती है। भले ही वे अधूरे टुकड़े हों, लेकिन अमीनो एसिड के छोटे खंड अभी भी एक लक्ष्य प्रोटीन के इंटरफेस के लिए बाध्य कर सकते हैं, देशी इंटरैक्शन को पुनरावृत्ति कर सकते हैं। इस प्रक्रिया के माध्यम से, वे उस प्रोटीन के कार्य को बदल सकते हैं या अन्य प्रोटीनों के साथ इसकी बातचीत को बाधित कर सकते हैं।
इसलिए प्रोटीन के टुकड़े प्रोटीन इंटरैक्शन और सेलुलर प्रक्रियाओं पर दोनों बुनियादी शोध को सशक्त बना सकते हैं, और संभावित रूप से चिकित्सीय अनुप्रयोग हो सकते हैं।
हाल ही में प्रकाशित किया गया राष्ट्रीय विज्ञान अकादमी की कार्यवाहीजीव विज्ञान विभाग में विकसित एक नई विधि मौजूदा कृत्रिम बुद्धिमत्ता मॉडल पर कम्प्यूटेशनल रूप से प्रोटीन टुकड़ों की भविष्यवाणी करने के लिए बनाती है जो पूर्ण-लंबाई वाले प्रोटीनों को बाध्य और बाधित कर सकती है ई कोलाई। सैद्धांतिक रूप से, यह उपकरण किसी भी प्रोटीन के खिलाफ आनुवंशिक रूप से एन्कोडेबल अवरोधकों को जन्म दे सकता है।
यह काम जीव विज्ञान के एसोसिएट प्रोफेसर और हावर्ड ह्यूजेस मेडिकल इंस्टीट्यूट के अन्वेषक जीन-वेई ली की प्रयोगशाला में किया गया था, जो कि जे ए स्टीन (1968) की लैब के साथ मिलकर जीव विज्ञान के प्रोफेसर, बायोलॉजिकल इंजीनियरिंग के प्रोफेसर और विभाग के प्रमुख एमी कीटिंग के साथ थे।
लीवरेजिंग मशीन लर्निंग
Fragfold नामक कार्यक्रम, Alphafold का लाभ उठाता है, एक AI मॉडल, जिसने हाल के वर्षों में जीव विज्ञान में अभूतपूर्व प्रगति को प्रोटीन फोल्डिंग और प्रोटीन इंटरैक्शन की भविष्यवाणी करने की अपनी क्षमता के कारण प्रेरित किया है।
परियोजना का लक्ष्य टुकड़ा अवरोधकों की भविष्यवाणी करना था, जो अल्फफोल्ड का एक उपन्यास अनुप्रयोग है। इस परियोजना के शोधकर्ताओं ने प्रयोगात्मक रूप से पुष्टि की कि बाध्यकारी या निषेध के लिए फ्रेगफोल्ड की आधी से अधिक भविष्यवाणियां सटीक थीं, तब भी जब शोधकर्ताओं के पास उन इंटरैक्शन के तंत्र पर कोई पिछला संरचनात्मक डेटा नहीं था।
“हमारे परिणामों से पता चलता है कि यह एक सामान्य दृष्टिकोण है जो उन बाध्यकारी मोड को खोजने के लिए है जो प्रोटीन फ़ंक्शन को बाधित करने की संभावना रखते हैं, जिसमें उपन्यास प्रोटीन लक्ष्यों के लिए भी शामिल है, और आप इन भविष्यवाणियों का उपयोग आगे के प्रयोगों के लिए एक शुरुआती बिंदु के रूप में कर सकते हैं,” सह-लेखक एंड्रयू सविनोव, ली लैब में एक पोस्टडॉक कहते हैं। “हम वास्तव में इसे ज्ञात कार्यों के बिना प्रोटीन पर लागू कर सकते हैं, ज्ञात बातचीत के बिना, यहां तक कि ज्ञात संरचनाओं के बिना, और हम इन मॉडलों में कुछ विश्वसनीयता रख सकते हैं जो हम विकसित कर रहे हैं।”
एक उदाहरण FTSZ है, एक प्रोटीन जो सेल डिवीजन के लिए महत्वपूर्ण है। यह अच्छी तरह से अध्ययन किया गया है, लेकिन एक ऐसा क्षेत्र है जो आंतरिक रूप से अव्यवस्थित है और इसलिए, विशेष रूप से अध्ययन के लिए चुनौतीपूर्ण है। अव्यवस्थित प्रोटीन गतिशील हैं, और उनके कार्यात्मक बातचीत बहुत संभावना है क्षणभंगुर हैं – इतनी संक्षेप में कि वर्तमान संरचनात्मक जीव विज्ञान उपकरण एकल संरचना या बातचीत पर कब्जा नहीं कर सकते हैं।
शोधकर्ताओं ने विभिन्न प्रोटीनों के साथ कई नए बाध्यकारी बातचीत की पहचान करने के लिए आंतरिक रूप से अव्यवस्थित क्षेत्र के टुकड़े सहित एफटीएसजेड के टुकड़ों की गतिविधि का पता लगाने के लिए फ्रैगफोल्ड का लाभ उठाया। समझ में यह छलांग FTSZ की जैविक गतिविधि को मापने वाले पिछले प्रयोगों की पुष्टि और विस्तार करती है।
यह प्रगति भाग में महत्वपूर्ण है क्योंकि यह अव्यवस्थित क्षेत्र की संरचना को हल किए बिना बनाया गया था, और क्योंकि यह फ्रैगफोल्ड की संभावित शक्ति को प्रदर्शित करता है।
“यह एक उदाहरण है कि कैसे Alphafold मौलिक रूप से बदल रहा है कि हम आणविक और कोशिका जीव विज्ञान का अध्ययन कैसे कर सकते हैं,” कीटिंग कहते हैं। “एआई तरीकों के रचनात्मक अनुप्रयोग, जैसे कि फ्रैगफोल्ड पर हमारा काम, अप्रत्याशित क्षमताओं और नए अनुसंधान निर्देशों को खोलते हैं।”
निषेध, और परे
शोधकर्ताओं ने प्रत्येक प्रोटीन को कम्प्यूटेशनल रूप से विखंडित करके इन भविष्यवाणियों को पूरा किया और फिर मॉडलिंग की कि कैसे वे टुकड़े बातचीत के भागीदारों से जुड़ेंगे जो उन्होंने सोचा था कि वे प्रासंगिक थे।
उन्होंने जीवित कोशिकाओं में उन्हीं टुकड़ों के प्रभावों के लिए पूरे अनुक्रम में अनुमानित बाइंडिंग के नक्शों की तुलना की, उच्च-थ्रूपुट प्रयोगात्मक मापों का उपयोग करके निर्धारित किया गया जिसमें लाखों कोशिकाएं प्रत्येक एक प्रकार के प्रोटीन टुकड़े का उत्पादन करती हैं।
Alphafold तह की भविष्यवाणी करने के लिए सह-विकासवादी जानकारी का उपयोग करता है, और आमतौर पर प्रोटीन के विकासवादी इतिहास का मूल्यांकन करता है, जो हर एक भविष्यवाणी के लिए कई अनुक्रम संरेखण नामक कुछ का उपयोग करता है। MSAs महत्वपूर्ण हैं, लेकिन बड़े पैमाने पर भविष्यवाणियों के लिए एक अड़चन हैं-वे समय और कम्प्यूटेशनल शक्ति की एक निषेधात्मक राशि ले सकते हैं।
Fragfold के लिए, शोधकर्ताओं ने एक बार एक पूर्ण-लंबाई वाले प्रोटीन के लिए MSA की पूर्व-गणना की, और उस परिणाम का उपयोग उस पूर्ण-लंबाई वाले प्रोटीन के प्रत्येक टुकड़े के लिए भविष्यवाणियों को निर्देशित करने के लिए किया।
साविनोव, कीटिंग लैब के पूर्व छात्र सेबस्टियन स्वानसन पीएचडी ’23 के साथ मिलकर, एफटीएसजेड के अलावा प्रोटीन के एक विविध सेट के निरोधात्मक टुकड़ों की भविष्यवाणी की। उनके द्वारा खोजे गए इंटरैक्शन के बीच लिपोपॉलेसेकेराइड ट्रांसपोर्ट प्रोटीन एलपीटीएफ और एलपीटीजी के बीच एक जटिल था। LPTG के एक प्रोटीन टुकड़े ने इस बातचीत को बाधित किया, संभवतः लिपोपॉलेसेकेराइड के वितरण को बाधित किया, जो कि एक महत्वपूर्ण घटक है ई कोलाई सेलुलर फिटनेस के लिए आवश्यक बाहरी कोशिका झिल्ली।
“बड़ा आश्चर्य यह था कि हम इस तरह की उच्च सटीकता के साथ बाध्यकारी की भविष्यवाणी कर सकते हैं और वास्तव में, अक्सर बाध्यकारी की भविष्यवाणी करते हैं जो निषेध से मेल खाती है,” साविनोव कहते हैं। “हर प्रोटीन के लिए हमने देखा है, हम अवरोधकों को खोजने में सक्षम हैं।”
शोधकर्ताओं ने शुरू में इनहिबिटर के रूप में प्रोटीन के टुकड़ों पर ध्यान केंद्रित किया था क्योंकि क्या एक टुकड़ा कोशिकाओं में एक आवश्यक कार्य को अवरुद्ध कर सकता है, व्यवस्थित रूप से मापने के लिए एक अपेक्षाकृत सरल परिणाम है। आगे देखते हुए, साविनोव भी निषेध के बाहर टुकड़ा फ़ंक्शन की खोज करने में रुचि रखते हैं, जैसे कि टुकड़े जो प्रोटीन को स्थिर कर सकते हैं, वे इसके कार्य को बढ़ाते हैं, बढ़ाते हैं या बदल सकते हैं, या प्रोटीन गिरावट को ट्रिगर करते हैं।
सिद्धांत रूप में डिजाइन
यह शोध सेलुलर डिज़ाइन सिद्धांतों की एक प्रणालीगत समझ विकसित करने के लिए एक प्रारंभिक बिंदु है, और सटीक भविष्यवाणियों को बनाने के लिए गहरे-सीखने वाले मॉडल किन तत्वों को चित्रित कर सकते हैं।
सविनोव कहते हैं, “एक व्यापक, आगे बढ़ने वाला लक्ष्य है जिसे हम बना रहे हैं।” “अब जब हम उनकी भविष्यवाणी कर सकते हैं, तो क्या हम भविष्यवाणियों और प्रयोगों से हमारे पास मौजूद डेटा का उपयोग कर सकते हैं ताकि यह पता लगाया जा सके कि अल्फफोल्ड ने वास्तव में क्या सीखा है कि एक अच्छा अवरोधक क्या है?”
सविनोव और सहयोगियों ने यह भी कहा कि कैसे प्रोटीन के टुकड़े बांधते हैं, अन्य प्रोटीन इंटरैक्शन की खोज करते हैं और विशिष्ट अवशेषों को म्यूट करते हैं कि वे इंटरैक्शन कैसे बदलते हैं कि कैसे टुकड़ा अपने लक्ष्य के साथ बातचीत करता है।
प्रयोगात्मक रूप से कोशिकाओं के भीतर हजारों उत्परिवर्तित टुकड़ों के व्यवहार की जांच करना, एक दृष्टिकोण जिसे गहरी उत्परिवर्ती स्कैनिंग के रूप में जाना जाता है, ने प्रमुख अमीनो एसिड का खुलासा किया जो निषेध के लिए जिम्मेदार हैं। कुछ मामलों में, उत्परिवर्तित टुकड़े उनके प्राकृतिक, पूर्ण-लंबाई अनुक्रमों की तुलना में अधिक शक्तिशाली अवरोधक थे।
“पिछले तरीकों के विपरीत, हम प्रयोगात्मक संरचनात्मक डेटा में टुकड़ों की पहचान करने तक सीमित नहीं हैं,” स्वानसन कहते हैं। “इस काम की मुख्य ताकत उच्च-थ्रूपुट प्रयोगात्मक निषेध डेटा और अनुमानित संरचनात्मक मॉडल के बीच परस्पर क्रिया है: प्रयोगात्मक डेटा हमें उन टुकड़ों की ओर मार्गदर्शन करता है जो विशेष रूप से दिलचस्प हैं, जबकि फ्रैगफोल्ड द्वारा भविष्यवाणी की गई संरचनात्मक मॉडल एक विशिष्ट, परीक्षण योग्य परिकल्पना प्रदान करते हैं कि कैसे आणविक स्तर पर टुकड़े कार्य करते हैं।”
साविनोव इस दृष्टिकोण के भविष्य और इसके असंख्य अनुप्रयोगों के बारे में उत्साहित हैं।
“कॉम्पैक्ट, आनुवंशिक रूप से एन्कोडेबल बाइंडर्स बनाकर, Fragfold प्रोटीन फ़ंक्शन में हेरफेर करने के लिए संभावनाओं की एक विस्तृत श्रृंखला खोलता है,” ली सहमत हैं। “हम कार्यात्मक टुकड़ों को वितरित करने की कल्पना कर सकते हैं जो देशी प्रोटीन को संशोधित कर सकते हैं, उनके उप -स्थानीयकरण को बदल सकते हैं, और यहां तक कि सेल बायोलॉजी का अध्ययन करने और रोगों के इलाज के लिए नए उपकरण बनाने के लिए उन्हें फिर से तैयार कर सकते हैं।”
। सविनोव (टी) सेबस्टियन स्वानसन